- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Leyendo...
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
Boton play
![]()
Boton play
![]()
60 Cartas en este set
- Frente
- Atrás
- 3er lado (pista)
|
Enlace metálico
|
Enlace no direccional
Enlace primario |
|
|
# cuántico principal
|
Define niveles energéticos principales
|
|
|
Enlace covalente
|
Enlace primario
|
|
|
Enlace primario
|
Enlace iónico
Enlace covalente Enlace metálico |
|
|
Enlaces secundarios
|
Van der Waals
Puentes de Hidrógeno Dipolo inducido dipolo permanente |
|
|
Nitruración
|
Difusión con cianatos
|
|
|
# cuántico secundario
|
Específica subnivel y subcapa
|
|
|
Electronegatividad
|
Atracción de electrones
|
|
|
# cuántico de spin
|
Especifica el giro del electrón
|
|
|
Cementación
|
Difusión con C
|
|
|
Enlace iónico
|
Transferencia de electrones
|
Movimiento de un átomo electropositivo (metal) a otro electronegatividad (no metal).
|
|
¿Qué ocurre cuando las fuerzas repulsivas y las fuerzas atractivas se igualan?
|

No habrá fuerza neta entre los iones, y estos permanecerán a una distancia de equilibrio, equivalente a la distancia interiónica a (dº).
|
|
|
¿Cuál es el valor de la permisibilidad?
|
Eº= 8,85x10¯¹² C²/(N. m²)
|
Describe cómo un campo eléctrico afecta y es afectado por un medio.
|
|
¿Cuál es la ecuación de la energía potencial?
|

|

|
|
¿Cuál es la ecuación de la fuerza neta?
|

|
|
|
¿Cuál es la ecuación de la fuerza atractiva?
|
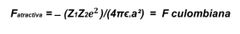
Cálculo de a, ejemplo:
Na^+Cl¯=0.095nm+0.181nm = 0.276nm x 10¯^(9)m/nm |

|
|
# cuántico magnético
|
Define orientación espacial de un orbital
|
|
|
Positrón
|
Antielectrón
|
|
|
Neutrón
|
Nucleón
|
|
|
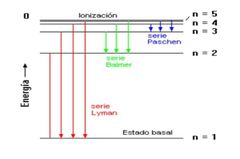
Átomo de H
|
Átomo de Bohr
|

|
|
Energía requerida para que el electrón abandone el átomo de H
|
n=1. -13.6 eV
n=2. -3.4 eV n=3. - 1.5 eV n=alfa 0 |
|
|
Radio iónico
|
Distancia entre electrón más alejado y el centro del núcleo del mismo átomo.
|
|
|
Radio atómico
|
Distancia entre dos núcleos de átomos adyacentes
|
|
|
Cu
|
Elemento químico
|
|
|
Austempering
|
Tratamiento que reemplaza el bonificado
|
Para acero de alto carbono.
Tratamiento isotérmico: Temperatura constante. |
|
Martempering
|
Requiere revenido posterior
|
|
|
Bonificado
|
Temple + Revenido
|
|
|
Temple |
Endurecimiento (Calentamiento menor al punto de fusión y enfriamiento rápido)
|
|
|
Revenido |
Disminuir tensiones internas (calentamiento antes de punto crítico)
|
|
|
Diferencia recocido y normalizado
|
Recocido: Ablanda el material
Normalizado: Libera tensiones y deja que el material se vuelva uniforme durante un enfriamiento a T° ambiente. |
|
|
Annealing
|
Recocido
|
|
|
Tempering
|
Revenido
|
|
|
Electronegatividad
|
Atracción de electrones.
|
|
|
Número de protones
|
Número atómico
|
|
|
Número másico
|
#Protones + #Neutrones
|
|
|
Diámetro núcleo de un átomo
|
10¯¹⁴m
|
|
|
Diámetro átomo
|
10¯¹°
|
|
|
Ir192
|
Isótopo
|
|
|
¿Si el e¯ del átomo H es excitado a una órbita superior (nivel energético), se absorbe o se emite una cantidad de energía.?
|
Se absorbe
|
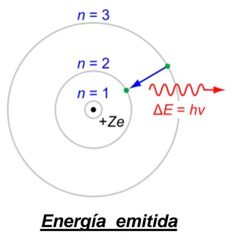
Radiación electromagnética llamada fotón.
|
|
Fórmula momento dipolar
|
u=qd
|
q= carga eléctrica.
d= distancia de separación entre los centros de carga. |
|
El momento dipolar tiene unidades en:
|
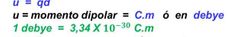
debye y C. m
|
|
|
La electronegatividad se caracteriza por:
|
-Ayudar a entender el comportamiento de los enlaces de los elementos químicos
-Tiene valores adimensionales Es mayor en elementos No metálicos |
|
|
Que factores son importantes para determinar la disposición del empaquetamiento iónico:
|
-Neutralidad electrónica.
-Tamaño de los iones. |
|
|
¿Entre qué se forman los enlaces iónicos?
|
Se forman entre iones opuestamente cargados, porque se produce una disminución neta de la energía potencial para los iones enlazados.
|
|
|
En el enlace iónico los iones
|
-Forman un sólido cristalino (mediante fuerzas electrostáticas [coulombianas)], no direccionales)
|
|
|
Tipos de enlaces dipolo existentes
|
-Permanente
-Oscilante |
|
|
Algunas características del tamaño atómico son:
|
-Es muy importante para el proceso de difusión en aleaciones y tratamiento superficiales.
|
|
|
Ledeburita
|
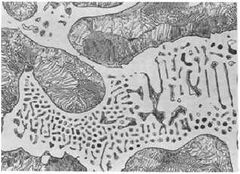
Forma de nido de abeja
|

-52% Cementita, 48% Austenita. Enfriamiento a 1145°
|
|
Martensita
|

|
Acicular.
Después de los carburos y la cementita es el más duro Osmondita |
|
Troostita (perlita fina)
|

|
Perlita fina.
Forma nodular radial. |
|
Sorbita (Perlita irregular)
|
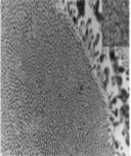
|
Agregado de cementita y ferrita.
|
|
Cementita
|
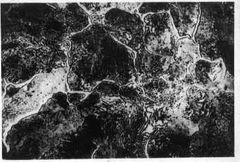
|
Es muy duro, lo que a su vez lo hace muy frágil.
|
|
Perlita
|

|
Forma parecida a las perlas
|
|
Los tratamientos térmicos que someten los materiales a T° de austenización son
|
Recocido y normalizado
|
|
|
Estructura cristalina martensita
|
BCT
|
|
|
Estructura cristalina de la ferrita alfa
|
BCC
|
|
|
Estructura cristalina ferrita gamma
|
FCC
|
|
|
Estructura cristalina ferrita delta
|
BCC
|
|
|
Estructura cristalina perlita
|
N. N
|
|
|
Estructura cristalina austenita
|
FCC
|