- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Leyendo...
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
Boton play
![]()
Boton play
![]()
60 Cartas en este set
- Frente
- Atrás
- 3er lado (pista)
|
Sustancias Puras
|
Tipo de materia que tiene una composición fija y constante
|
|
|
Elementos
|
Formados por un solo tipo de sustancia (átomos).
Fe |
|
|
Compuestos
|
Formados por la "unión química" de dos o más tipos de átomos. Se llaman (moléculas).
H20 |
|
|
Átomo
|
Parte más pequeña de un elemento que puede conservar sus propiedades
|
|
|
Molécula
|
Es la combinación de átomos de uno o varios átomos iguales o distintos.
|
|
|
Mezclas
|
Son la mayoría de materiales que no pueden clasificarse como sustancias puras, ya que no tienen propiedades fijas.
|
|
|
Mezclas homogéneas
|
Aquellas en las que las dos partes (soluto y solvente) no pueden distinguirse a simple vista.
|
|
|
Mezlcas heterogéneas
|
Aquellas en las que se pueden distinguir sus componentes a simple vista.
|
|
|
Soluciones
|
Aquellas que presentan una composición uniforme en casi toda la mezcla. Son de una sola fase
(Agua de mar) |
|
|
Coloides
|
Son aquellas en las que sus partículas se encuentran dispersas por todo el medio, no se sedimentan y son translúcidas.
Provocan efecto (Tyndall) (Leche, sangre) |
|
|
Suspensiones
|
Mezclas heterogéneas con partículas de suficiente tamaño para ser observadas. Estas pueden sedimentarse
(Cemento, pinturas) |
|
|
Quien descubrió el electrón
|
Thomson (1897)
|
|
|
Descubrió el proton
|
Rutherford (1920)
|
|
|
Descubrió el neutron
|
Chadwick (1932)
|
|
|
Número de masa (A)
|
Masa del átomo, se determina sumando el número de protones y neutrones
|
|
|
Número atómico (Z)
|
Es el número de protones que hay en el núcleo.
Si el átomo es neutron, tendrá la misma cantidad de electores. |
|
|
Ion
|
Es un átomo con carga eléctrica
Tiene más protones (cation) Tiene más electrones (anion) |
|
|
Isotopo
|
Átomos que tienen un mismo número atómico pero diferente numero de masa, por ello se deduse que tienen distintos neutrones.
|
|
|
Descubrio la radioactividad
|
Antonie H. Becquerel (1896)
|
|
|
Descubrieron radioactividad artificial
|
Irene Curie (1934)
|
|
|
Que describieron Pierre y Marie Curie
|
El polonio y el Radio (1898)
|
|
|
Modelo de Dalton (1808)
|
Consideraba al átomo como la partícula fundamental de la materia, con capacidad de asociarse con otras para formar moléculas
|
|
|
Modelo de Thomson
|
Al descubrir los electrones propuso que la materia es eléctricamente neutra, por lo que habría de contener también partículas postivas
(Modelo del pastel) |
|
|
Modelo de Rutherford
|
Describió la radiación alfa y beta y de ahí postulo que el átomo tiene un núcleo central donde está la carga postiva y en el exterior se encuentra la carga negativa
|
|
|
Modelo de Bohr (1913)
|
Explica qué los electrones están delimitados por unas órbitas circulares
|
|
|
Número cuántico principal (n)
|
Determina el tamaño del orbital con un número mayon a 0
n=1,2,3... |
|
|
Número cuántico azimutal (l)
|
Determina la forma del orbital y toma valores que van desde 0 a una unidad menos que n
|
|
|
Número cuántico magnético (m)
|
Determina la orientación del orbital, este depende del número l y toma valores de -l a +l pasando por el 0
|
|
|
Número cuántico espín (s)
|
Determina el "giro de electrón"
--> 1/2 <-- -1/2 |
|
|
Configuración Electrónica
|
1s 2s 2p 3s 3p 4s 3d 4p 5s
S=2 P=6 D=10 F=14 |
|
|
Familias y períodos
|
Las familias son aquellas que son en vertical y los periodos en horizontal
|
|
|
Metal
|
Tiene brillo, son maleables y ductiles, conducen la electricidad y calor puntos de fusión altos
Son electropositivos, agentes reductores, forman cationes |
|
|
No metal
|
No tienen brillo, no son maleables ni ductiles, malos conductores
Electronegativos, son agentes oxidantes, forman aniones Moléculas diatomicas y poliatomicas |
|
|
Metaloides
|
Tienen brillo metálico, sólidos, semiconductores electricidad, no conducen el calor
|
|
|
Potencial de ionización
|
Es la energía mínima necesaria para que un átomo (gaseoso) pueda liberar un electrón y quedarse con un ion +
Entre mayor número atómico, menor será la energía que se necesite |
|
|
Electronegatividad
|
Es la capacidad que tiene un átomo de atraer electrones cuando forma parte de un "compuesto"
Aumenta de izquierda a derecha y hacia arriba |
|
|
Radio atómico
|
Es la fuerza de atracción del núcleo a los electrones.
Aumenta de izquierda a derecha y hacia abajo |
|
|
Número de oxidación
|
Son los electrones que dispone el átomo al formar un compuesto
|
|
|
Valencia
|
Es la capacidad para combinarse de un átomo y cumplir su octeto
|
|
|
Enlace ionico
|
Transferencia de electrones entre metal y metal dando lugar a cationes y aniones que provocara fuerzas electrostáticas.
Cristales |
|
|
Enlace Covalente
|
Compartircion de electrones entre no metales
Forman covalente no polar Enlace entre elementos de misma electronegatividad y comparten los electrones de manera equitativa Covalente polar Se forma cuando un elemento tiene más electronegatividad y ejerce mayor atracción sobre los electrones Covalente coordinado Cuando un solo átomo comparte los electrones con otro. |
|
|
Enlace Metálico
|
Enlace entre metales y consiste en un intercambio rápido de electrones, generando que los electrones estén por todo el compuesto.
|
|
|
Mol, masa molar, número de moles y molaridad
|
Mol corresponde a la cantidad de sustancia
Masa molar = Número de masa de cada átomo Número de moles = masa / masa molar Molaridad = n° moles del soluto/litro de disolución = n/v = m/(Mm)(V) |
|
|
Acido
|
De sabor agrio, corrosivo con el metal y la piel, soluble en agua, conductor de la electricidad
Papel tornazol azul - rojo Escala ph de 0 a 6 |
|
|
Base
|
Sabor amargo, de sensación jabonosa, cáustico con la piel, soluble en agua, conductor elec.
Papel tornazol rojo - azul Escala ph de 8 a 14 |
|
|
Teorías ácido base
|

|
|
|
Óxido, ácido, hidróxido y sal
|
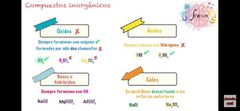
|
|
|
Neutralizacion
|
M1*V1=M2*V2
|
|
|
Ley de los gases ideales
|
PV=nRT PV=m/MM(R) (T)
n=0.082 Temperatura es en kelvin (273) |
|
|
Energía
|
Capacidad de llevar acabo un trabajo
|
|
|
Energía interna (E)
|
Es la energía total que tiene un sistema como consecuencia de la energía cinética y potencial
|
|
|
Primer ley de la termodinámica
|
Mejor conocida como ley de la conservación de la energía
^E=q-w q=calor + sistema absorbe = endo - sistema pierde = exo w=Trabajo + sistema realiza el trabajo - el trabajo es realizado sobre el sistema |
^E=q-w
|
|
Entalpia (H)
|
Es el contenido calorífico de una sustancia
^H=^H"producto" - ^H"reactivo" ^H>0 Endotermica + ^H<0 Exotermica - ^H= ^E + P^V |
|
|
Ley Hess
|
Establece que la entalpia de una reacción será la misma aún cuando se haga de manera indirecta o directa
|
|
|
Entropia (S)
|
Es el desorden o variación de los átomos, moléculas o iones en un sistema.
^S= ^H / T |
|
|
Energía libre o energía libre de Gibbs
|
Es la energía útil disponible para realizar un trabajo
^G = ^H - (T) (^S) G= - Será un proceso espontáneo G= + No será espontáneo G= 0 El proceso será en equilibrio |
|
|
Velocidad de reacción
|
V= Producto / t
|
|
|
Cinética Química
|
Estudia la velocidad con la que ocurren las reacciones químicas y los factores que afectan la velocidad
Factores son Concentración de los reactivos Naturaleza de los reactivos Temperatura Catalizadores Presión |
|
|
Equilibro químico y constante del equilibrio
|
Es el proceso en donde las reacciones suceden al mismo tiempo
Constante keq= productos / reactivos |
|
|
Principio de Le Chatelier y los factores que afectan el equilibrio
|
Dice que si en un sistema en equilibro surge una acción externa, el equilibro se moverá en la dirección que pueda disminuir o neutralizar dicha acción.
Los factores que afectan al equilibrio son Concentración Temperatura y presión |