- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Leyendo...
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
Boton play
![]()
Boton play
![]()
7 Cartas en este set
- Frente
- Atrás
|
Nombra las 6 propiedades periódicas más importantes.
|
-Carga nuclear efectiva (Zef)
-Radio Atómico (R.A.) -Radio Ionico (R.i.) -Electronegatividad (E.A.) o afinidad electrónica -Energía de Ionización (E.I) o potencial de Ionización -Electronegatividad. |
|
Carga Nuclear Efectiva. Explica y dibuja diagrama.
|

Carga con la que el núcleo es capaz de atraer a un electrón. Depende de la cantidad de protones del núcleo y de la distribución espacial de los electrones en el átomo.
Los electrones más próximos al núcleo son capaces de apantallar a los electrones más lejanos, disminuyendo la fuerza con la que son atraídos hacia el centro del átomo. |
|
Radio Atomico. Explica y dibuja diagrama.
|
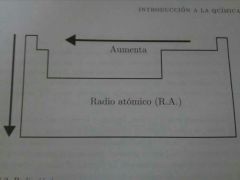
Es una referencia del tamaño del átomo.
En un periodo la carga nuclear efectiva aumenta de izquierda a derecha, es decir, la fuerza con que el núcleo atrae a los electrones aumenta, acercándolos al núcleo y reduciendo el tamaño del átomo. |
|
Radio Ionico. Escribe la desigualdad y explica.
|
R: Radio
Rcation<Rneutro<Ranion Debido a que los captan o ceden electrones, y la Zef permanece constante, el radio del átomo cambia. |
|
Energía o potencial de Ionización (P.I.). Explica y dibuja diagrama.
|
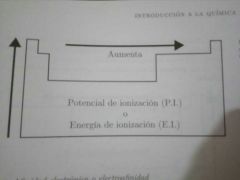
Es la medida de que tan difícil es quitarle un electrón a un átomo. A mayor cantidad de energía requerida, más difícil es sacar el electrón.
|
|
Afinidad Electrónica o Electroafinidad. Define y dibuja diagrama
|
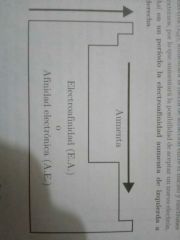
Mide la capacidad de un átomo para captar un electrón.
A mayor electroafinidad, más capaz es un átomo de estabilizar un electron captado. |
|
Electronegatividad. Define y dibuja Diagrama
|
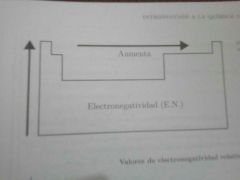
capacidad de un átomo de una molécula para atraer hacia si los electrones en un enlace Químico.
|