- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Leyendo...
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
Boton play
![]()
Boton play
![]()
13 Cartas en este set
- Frente
- Atrás
|
Configuración Espacial Absoluta de Complejos Octaédricos
|
No se puede deducir de la dirección de rotación su configuración.
Los métodos experimentales utilizados son: a) Dispersión Anómala de Rayos X (Bijvoet) b) Dispersión Óptica Rotatoria c) Dicroísmo Circular |
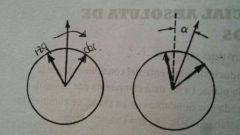
Dispersión Óptica Rotatoria
|
El vector eléctrico de la luz polarizada plana se encuentra confinado en un plano y oscila siguiendo una onda sinosoidal con la longitud de onda de la luz. La luz polarizada plana es el resultado de la interferencia de 2 ondas de igual amplitud, una avanzando a la dcha y otra abla izq.
|
|
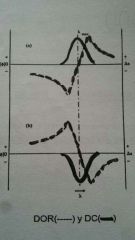
Dicroísmo Circular
|
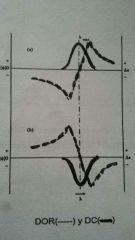
|
|
Teoría del Campo Cristalino
|
Teoría puramente iónica, no tiene en cuenta la covalencia. Interacciones totalmente electrostáticas. Consideramos el metal una carga puntual positiva y los ligandos cargas puntuales negativas.
|
|
TCC. Simetría Oh.
|

Los orbitales t2g se estabilizan. Los eg se desestabilizan al estar enfrentados a los Ls.
En el desdoblamiento, el baricentro de los orbitales d se mantiene de tal forma que los orbitales t2g se estabilizan en el mismo nivel que se desestabilizan los orbitales eg ((2/5)10Dq y (-3/5)10Dq). 10Dq es la magnitud del desdoblamiento de ambos orbitales juntos. El desdoblamiento de los niveles d en un campo octaédrico da origen a transiciones electrónicas d-d que dan lugar al color en los complejos. |
|
Campo Débil o Alto Espín
|
El e- ha ganado energía con el desdoblamiento y está en un orbital inestable. La energía del desdoblamiento es menor que la energía de apareamiento (mácimo desapareamiento entrando en eg2.
|
|
Campo Fuerte o Bajo Espín
|
El e- no gana energía de desdoblamiento, tendrá sus e- apareados ganando energía de apareamiento. La energía de apareamiento es menor que la energía del desdoblamiento. Prefiere aparearse por lo que la molécula será más estable. No pasa al eg2 sino que se queda en el t2g.
|
|
EECC Oh
|
EECC=(-0.4x+0.6y)Ao
x:e- t2g estabiliza y:e- eg desestabiliza |
|
Factores que Afectan al Desdoblamiento de los Orbitales d
|
1) Naturaleza del Ión Metálico
2) Naturaleza de los Ligandos 3) Numero de Coordinación y Geometría del Complejo 4) Estado de Ocidación del Ión Metálico 5) Efecto Jahn-Teller |
|
Efecto del Ión Metálico en el Desdoblamiento
|
Al aumentar el tamaño de los orbitales d, más expandidos estarán en el espacio y mayor será el desdoblamiento.
Al bajar en el grupo aumenta el volumen y por tanto el desdoblamiento. La diferencia es muy pequeña de la 4a a la 5a serie debido a la contracción lantanida. |
|
Efecto de la Naturaleza de los Ligandos en el Desdoblamiento
|
Los ligandos se pueden agrupar en la serie espectroquímica según la intensidad del campo cristalino.
La teoría del campo cristalino jo puede explicar esta serie, y es uno de sus fallos. Está basada en interacciones de de tipo electrostático. La carga - de menor tamaño podría acercarse más al metal y más fuertemente interacciona con los orbitales d, aumentando el desdoblamiento. Esta serie se cumole bien para elementos de la 1a serie de transición, para la segunda y tercera puede variar debido a la contracción lantánida. |
|
Serie Espectroquímica
|
(CD) I-<Br-<S2-<SCN-<Cl-<NO3-<N3-<F-<OH-<C2O4-2=H20]NCS-<CH3CN<py<NH3<en<bipy<phen<NO2-<PPh3<CN-=CO (CF)
|
|
Efecto del Número de Coordinación y Geometría del Complejo
|
Los que tienen menor energía serían haluros, vemos que cuanto más pequeño es el haluro, más cerca está del metal, más interacciona y mayor es el dedoblamiento.
Entre NH3 y H2O, el NH3 tiene menos energía yabque posee un par se e- libres, lo que hace que se acerque más al metalve interaccione; por el contrario el H2O tiene 2 pares de e- libres por lo que cuesta más interaccionar. Al bajar en el grupo aumenta el tamaño, se aleja del metal e interacciona menos (campo débil). |