- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Leyendo...
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
Boton play
![]()
Boton play
![]()
19 Cartas en este set
- Frente
- Atrás
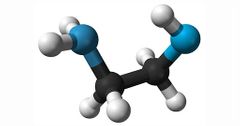
Aminas
|
Compuesto orgánico que contiene nitrógeno, en salud muchos se usan como descongestionantes, anestésicos y sedantes. Como la dopamina por ejemplo. Son derivados del amoniaco.
|
|
Nomenclatura de las Aminas
|
Su terminación es -amina. Se debe de enumerar la cadena para conocer la posición de NH2, se utiliza el prefijo N- por cada grupo alquilo enlazado.
|
|
Ejemplos de nomenclatura
|
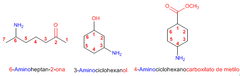
|
|
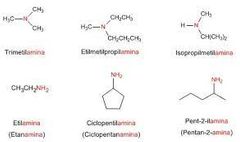
Nombre comunes de Aminas
|
Se usan cuando los grupos alquilo no están ramificados. Los grupos alquilo enlazados al átomo de nitrógeno se mencionan en orden alfabético. Los prefijos di y tri se utilizan para indicar dos o tres grupos idénticos.
Como ejemplo, etilamina. |
|
Con dos grupos funcionales
|
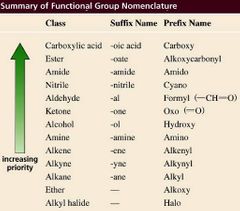
Los que tienen prioridad más alta son los ácidos carboxílicos.
|
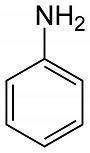
Aminas Aromáticas
|

Usan el nombre anilina. Anilina es la amina aromática más simple. Se descubrió en 1826, que luego se ha utilizado para fabricar tintes sintéticos.
|
|
Clasificación de Aminas
|
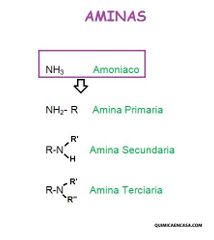
Las aminas se clasifican contando el número de átomos de carbono directamente enlazados al átomo de nitrógeno.
|
|
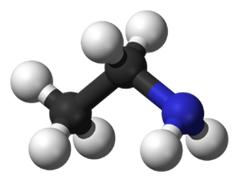
Aminas Primarias
|

El átomo de nitrógeno está enlazado a un grupo alquilo.
|
|
Amina secundaria
|
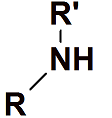
Átomo de nitrógeno está enlazado a dos grupos alquilo.
|
|
Amina terciaria
|
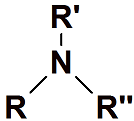
El átomo de nitrógeno está enlazado a tres grupos alquilo.
|
|
Fórmulas de esqueleto
|
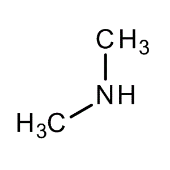
Se muestran los átomos de hidrógeno enlazados al átomo de N.
|
|
Propiedades de las aminas
|
Contienen enlaces polares N-H. las aminas primarias y secundarias pueden formar enlaces por puente de hidrógeno mutuos.
|
|
Puntos de ebullición
|
Más altos que los alcanos, más bajos que los alcoholes. Las aminas primarias con capaces de formar más puentes de hidrógeno que una secundaria. Las aminas terciarias no pueden formar puentes de hidrógeno entre ellas, tienen puntos de ebullición más bajos.
|
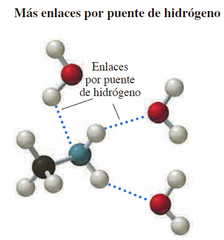
Solubilidad en agua
|
Con uno a seis átomos de carbono son solubles en agua. Aminas primarias son más solubles que las aminas terciarias. Las aminas primarias, secundarias y terciarias forman enlaces por puente de hidrógeno con moléculas de agua.
|
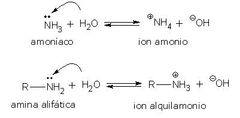
Las aminas reaccionan como bases en agua
|
Las aminas son bases Bronsted-Lawry, al reaccionar en agua los productos son ión alquilamonio con carga positiva y un ión hidróxido con carga negativa. Al nombrarlo se le agrega la palabra ión y terminación amonio al nombre de su grupo alquilo.
|
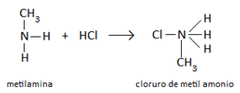
Sales de amonio
Reacción de Neutralización |
Una amina actúa como una base y reacciona con un ácido para formar sal de amonio. El par solitario de electrones en el átomo de nitrógeno acepta un protón H+ de un ácido para producir una sal de amonio sin formar agua.
|
|
Sales de amonio cuaternarias
|
En una sal de amonio cuaternaria, un átomo de nitrógeno se enlaza a cuatro grupos carbono,
lo que la clasifica como una amina 4. Como en otras sales de amonio, el átomo de nitrógeno tiene carga positiva. |
|
Propiedades de las sales de amonio
|
Son sólidas a temperatura ambiente, inodoras y solubles en agua y líquidos corporales. Se usa como broncodilatador y descongestionantes. Para alivio de comezón y dolor por irritaciones en la piel y salpullidos.
|
|
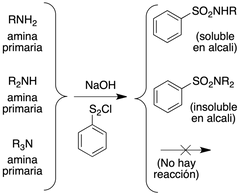
Cuando una sal de amonio reacciona con una base fuerte como el NaOH, se convierte
de nuevo en amina, que también se llama amina libre o base libre |