- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Leyendo...
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
Boton play
![]()
Boton play
![]()
35 Cartas en este set
- Frente
- Atrás
- 3er lado (pista)
|
Qué es la química
|
Es la ciencia que estudia la materia y los cambios que sufre esta
|
|
|
Qué es la materia
|
Todo lo que nos rodea y ocupa un lugar en el espacio y tiene masa
|
|
|
La materia se divide...
|
Un cuerpo en Particulas - por medios mecánicos
Las partículas en moléculas - por medios físicos Las moléculas en átomos - por medios químicos El átomo en partículas subatomicas: protones, electrones y neutrones - por medio nuclear |
|
|
Qué es un átomo
|
La particula más pequeña indivisible que existe
|
|
|
Clasificación de la materia según su composición
|
Materia:
1.- mezclas 1.1.- heterogéneas 1.2.-homogéneas 2.- sustancias puras 2.1.- compuestos 2.2.- elementos |
|
|
Isotopos
|
Sin átomos de un mismo elemento que tienen el mismo número atómico (z) pero distinto número másico (A)
|
|
|
Isotopos inestables
|
Los átomos inestables son radiactivos: sus núcleos cambian o se desintegran emitiendo radiaciones
|
|
|
Qué isotopo se pone en la tabla periódica
|
El más abundante en el planeta
*todos lo elementos tienen isotopos y dependiendo de su numero másico se le pone el nombre, ejem: carbono-14 |
|
|
Tres formas de representar las configuraciones eléctronicas de los átomos
|
1.-forma condensada
2.-diagrama del orbital 3.-símbolo de kernel |
|
|
Números cuánticos (4)
|
n
l m S (spin) |
|
|
Número cuántico principal
|
n
Indica el nivel de energía en el que se encuentra un electrón, por lo tanto, indica la cercanía con el núcleo. n: 1 hasta 7 |
|
|
Número cuántico secundario
|
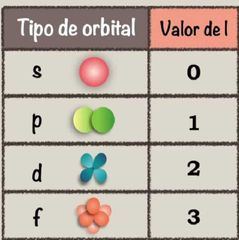
l
Indica el tipo (forma) de orbital. También es llamado de momento angular o azimutal. |
|
|
Subnivel de energía
|
La forma del orbital altera la energía del electrón
|
|
|
La energía de un electrón depende de su número cuántico:(2)
|
n & l
Principal y secundario |
|
|
Número cuántico magnético
|
ml
Describe la orientación en el espacio del orbital |
|
|
Número cuántico de espín
|
ms
Describe cómo es el giro de un electrón sobre su propio eje. ms: toma el valor de +1/2 o -1/2 |
|
|
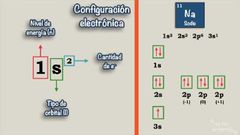
Configuración electrónica
|
Es la representación de la distribución específica de los electrones de un átomo o ion en sus orbitales
|
|
|
Qué es el número atómico (z)
|
Es el número de protones en el núcleo del átomo de un elemento
|
|
|
Cuándo se dice que es un átomo neutro
|
En un átomo neutro el número de protones es igual al número de neutrones, de manera que el número atómico también indica el número de electrones presentes en un átomo.
|
|
|
Número de masa (A)
|
Es el total de neutrones y protones presentes en el núcleo de un átomo de un elemento.
|
|
|
Isotopos
|
Átomos que tienen el mismo número atómico pero diferente número másico.
|
|
|
Iones
|
Un ion es un átomo o un grupo de átomos que tiene una carga neta positiva o negativa
|
|
|
Catión
|
La pérdida de uno o más electrones a partir de un átomo neutro, forma un catión, un ion con carga neta positiva.
|
|
|
Para que se utilizan los números cuánticos
|
Para describir los orbitales atómicos e identificar los electrones que están dentro.
|
|
|
Número cuántico n
|
Toma valores de 1 a 7
Cuánto más grande es el valor de n, mayor es la distancia entre un electrón en el orbital respecto del núcleo, y en consecuencia, el orbital es más grande. |
|
|
Número cuántico del momento angular l
|
Expresa la "forma" de los orbitales.
Tiene todos los valores posibles desde 0 hasta (n-1), sus valores se designan con las letras s, p, d, f, g, h = 0,1,2,3,4 |
|
|
El número cuántico magnético (ml)
|
Describe la orientación del orbital en el espacio.
Dentro del subnivel el valor de ml depende de "l", sus valores son de - l a +l incluyendo el 0 |
|
|
Número cuántico de espín (ms)
|
Muestra los dos posibles giros de un electrón, uno en sentido de las manecillas del reloj (+1/2) y otro en sentido contrario (-1/2)
|
|
|
*
Cuáles son los 4 números cuánticos para un electrón de un orbital 2s |
n=2, l=0, ml= 0, ms= +1/2 o -1/2
|
|
|
Datos efecto pantalla
|
*Se dice que un electrón en orbitales 2s o 2p está parcialmente "apantallado"de la fuerza de atracción del núcleo por los electrones 1s.
*La consecuencia importante de este efecto pantalla es que disminuye la atracción electrostática entre los protones del núcleo y el electrón del orbital 2s o 2p. |
|
|
Cuanto
|
Es la cantidad más pequeña de energía electromagnética (EM) que puede emitir o absorber un átomo.
En otras palabras: es la cantidad mínima de energía que puede ganar o perder un átomo. |
|
|
Fotones
|
Es una particula que forma una radiación electromagnética, la cual, no posee masa y transporta un cuanto de energía. Es la mínima cantidad de energía que posee una radiación electromagnética.
|
|
|
Cuanto más grande es el valor de n
|
Mayor es la longitud entre un electrón en el orbital respecto al núcleo y en consecuencia el orbital es más grande
|
|
|
Tipo de orbital s, p, d, f (nombres)
|
S - de sharp
P - de principal d - de difuse f - de fundamental |
|
|
Tabla periódica
|
Fue creada en 1869 por el ruso Dimitri Mendeleyev
|