- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Leyendo...
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
Boton play
![]()
Boton play
![]()
5 Cartas en este set
- Frente
- Atrás
|
Se pueden encontrar reacciones que absorben energía en forma de calor o que la liberan.
|
Reacciones exotérmicas
Es toda aquella reacción química que provoca la emisión de energía en forma de calor. Hay casos en los que también se libera energía cinética o lumínica, a ejemplo de esto se tienen las explosiones y los juegos artificiales. |
|
Criterio de dirección: hay reacciones que ocurren en una dirección (reactivos a productos), y otras en las dos direcciones (reactivos a productos, y productos a reactivos)
|
Reacciones reversibles
Estas reacciones pueden tienen lugar en los dos sentidos, pues a medida que se obtienen productos, estos a su vez vuelven a reaccionar entre sí para dar nuevamente reactivos. Es decir, estas reacciones pueden transcurrir hacia la derecha y hacia la izquierda, y se simbolizan mediante una doble flecha. |
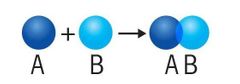
Reacciones de combinación, síntesis o adición
En este tipo de reacciones químicas se combinan dos o más sustancias para formar un único compuesto. La combinación de metal y oxígeno para formar óxidos es un ejemplo, dado que da pie a moléculas relativamente estables que en algunos casos pueden ser utilizadas para fabricar materiales frecuentes en nuestra vida cotidiana. |
Reacciones de descomposición
Las reacciones de descomposición son aquellas en las que un compuesto concreto se descompone y divide en dos o más sustancias. Es lo que ocurre por ejemplo cuando se produce la electrólisis del agua, separándose el agua en hidrógeno y oxígeno. |
|
Criterio de ordenamiento de átomos: se basa en la forma como se desplazan y reorganizan los átomos al pasar de reactivos a productos
|
Reacciones irreversibles
Son aquellas reacciones químicas que, una vez iniciadas, transcurren hasta que los reactivos (o el reactivo límite) se consuman por completo. Estas reacciones tienen lugar en un solo sentido (hacia la derecha) y se simbolizan con una flecha en una sola dirección. |
|
Criterio de propiedades de la transformación: se basa en el tipo de transformaciones que presentan las moléculas al pasar de reactivos a productos
|
Reacciones de intercambio o doble sustitución
Se trata de una reacción semejante a la de la sustitución, con la excepción de que en en este caso uno de los elementos que forman uno de los compuestos pasa el otro a la vez que este segundo compuesto pasa al primero uno de sus propios componentes. Es necesario para que se produzca la reacción que al menos uno de los compuestos no se disuelva. |