- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Leyendo...
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
Boton play
![]()
Boton play
![]()
14 Cartas en este set
- Frente
- Atrás
- 3er lado (pista)
|
AZUL DE TOLUIDINA
|
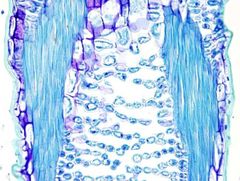
El azul de toluidina es un colorante que se usa para tinciones rápidas en histología vegetal. Es muy fácil de preparar y el tiempo de tinción es muy corto. Además, produce una reacción metacromática, es decir, es capaz de dar color diferente a diferentes estructuras. El color va desde verde brillante hasta púrpura, pasando por una gama de azules.
|
Paredes celulares primarias delgadas: azul a púrpura.
Paredes celulares secundarias: verde brillante. Cutícula madura: verde brillante. |
|
HEMATOXILINA Y EOSINA
|
La mayoría de las células y matrices extracelulares no poseen un color propio por lo que su observación directa al microscopio óptico no permite observar sus características morfológicas. Para poder observarlos se emplean colorantes, sustancias dotadas de color que se unen de manera más o menos específica a determinadas estructuras del tejido.
|
Colágeno: rosa pálido.
Músculo: rosa fuerte. Queratina: rojo intenso. Citoplasma: rosado. Núcleos: azul oscuro o púrpura (en realidad se tiñe sólo la cromatina). Eritrocitos: color cereza. |
|
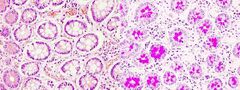
PAS-AZUL CIAN
|
Este método de tinción se emplea para detectar polisacáridos en tejidos, tanto glucógeno como mucopolisacáridos. También es una buena tinción para membranas basales y cartílago. Cualquier fijador es apropiado para esta técnica.
La combinación del PAS con el azul alcián nos permite distinguir a los mucopolisacáridos ácidos, teñidos con el azul alcián, del resto de mucopolisacáridos. Todos los mucopolisacáridos se tiñen con el PAS. |
Glúcidos: rosa intenso a fucsia
Mucopolisacáridos ácidos: azul |
|
PAS-HEMATOXILINA
|
Este método de tinción se emplea para detectar polisacáridos en los tejidos, tanto glucógeno como mucopolisacáridos. También es una buena tinción para membranas basales y cartílago. Cualquier fijador es apropiado para esta técnica.
|
Glúcidos: rosa intenso a fucsia
Núcleos: azul oscuro (en realidad se tiñe sólo la cromatina) |
|
SAFRANINA AZUL ACIANIL
|
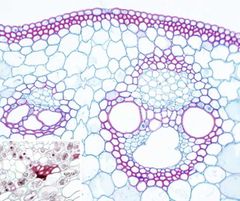
Así como para observar tejidos animales es imprescindible usar colorantes que diferencien el núcleo del citoplasma, en el caso de los tejidos y órganos vegetales se usan colorantes con afinidad por las paredes celulares. La tinción vegetal por excelencia se caracteriza por usar la safranina, que presenta afinidad por las paredes lignificadas (paredes secundarias), y un segundo colorante que puede ser el azul alcián o en ocasiones el verde rápido, ambos con afinidad por las paredes no lignificadas (paredes primarias).
|
Paredes vegetales primarias: azul (con azul alcián) o verde (con verde rápido).
Paredes vegetales secundarias: rojo. Paredes con suberina y cutina: rojo. |
|
SAFRANINA-VERDE RÁPIDO
|

Así como para observar tejidos animales es imprescindible usar colorantes que diferencien el núcleo del citoplasma, en el caso de los tejidos y órganos vegetales se usan colorantes con afinidad por las paredes celulares. La tinción vegetal por excelencia se caracteriza por usar la safranina, que presenta afinidad por las paredes lignificadas (paredes secundarias), y un segundo colorante que puede ser el azul alcián o en ocasiones el verde rápido, ambos con afinidad por las paredes no lignificadas (paredes primarias).
|
Paredes vegetales primarias: azul (con azul alcián) o verde (con verde rápido).
Paredes vegetales secundarias: rojo. Paredes con suberina y cutina: rojo. |
|
SAFRANINA DE JOHANSE VERDE RÁPIDO
|
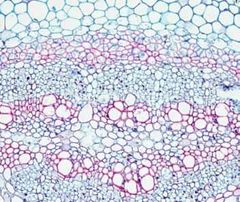
Así como para observar tejidos animales es imprescindible usar colorantes que diferencien el núcleo del citoplasma, en el caso de los tejidos y órganos vegetales se usan colorantes con afinidad por las paredes celulares. La tinción vegetal por excelencia se caracteriza por usar la safranina, que presenta afinidad por las paredes lignificadas (paredes secundarias), y un segundo colorante que puede ser el azul alcián o en ocasiones el verde rápido, ambos con afinidad por las paredes celulísicas (paredes primarias). La safranina O de Johansen combinada con el verde rápido es una buena técnica para teñir tejidos vegetales y diferenciar entre paredes celulares primarias y secundarias.
|
|
|
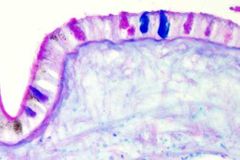
AZUL TOLUIDINA ÁCIDA
|
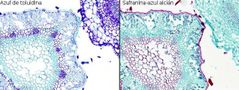
Se ha empleado para teñir matrix extracelular, sobre todo en cartílago pues pone de manifiesto proteoglicanos y glicosomainoglicanos, también para estudiar osteoblastos, mastocitos, botones gustativos, cromosomas y otros. Presenta metacromasia. Esta metacromasia es útil en las tejidos vegetales puesto que distingue las paredes celulares primarias de las secundarias. Molecularmente es una tiazina.
|
Paredes celulares primarias delgadas: azul a púrpura.
Paredes celulares secundarias: verde brillante. Cutícula madura: verde brillante. |
|
TINCIÓN DE NISSl
|
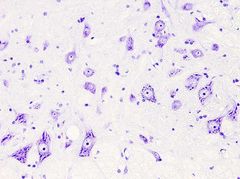
La tinción de Nissl es muy usada en secciones de tejido nervioso, aunque sirve para teñir ácido nucleicos en cualquier tejido. El colorante en el que se basa la tinción es normalmente el azul de toluidina o el violeta de cresilo. El más usado es el violeta de cresilo, que es el que se describe más abajo.
|
Núcleos: rosa - violeta.
Retí**** endoplasmático rugoso: púrpura. |
|
TRÍCRONICA DE GOMORI
|
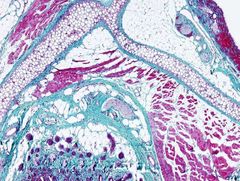
Esta tinción se usa para destacar el tejido muscular y el tejido conectivo propiamente dicho.
|
Colágeno: verde oscuro-celeste.
Músculo: rojo. Citoplasma: rosado. Núcleos: *****. |
|
TRÍCROMICA DE MASSON
|
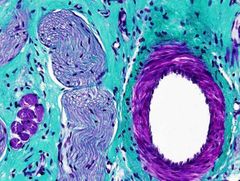
Emplea tres colorantes. Son la hematoxilina, la fucsina y el verde luz. Esta tinción es muy útil para poner de manifiesto las fibras de colágeno, y el conectivo en general, en comparación células musculares o epitelios. Se emplea mucho en la diagnosis de procesos tumorales. Hay muchas variantes de esta tinción adaptadas a las necesidades particulares de cada laboratorio.
|
Colágeno: verde azulado.
Músculo: rojo, marrón. Citoplasma: rosado. Núcleos: *****. Citoplasma: rosado. |
|
TRICRÓMICO DE VAN GIESON
|
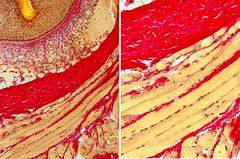
Es una tinción donde se combina la tinción nuclear mediante la hematoxilina férrica de Weigert con la mezcla ácido pícrico-fucsina ácida, la cual permite diferenciar cromáticamente las fibras colágenas del tejido conjuntivo.
|
Colágeno: rojo rosado.
Músculo: amarillo anaranjado. Citoplasma: amarillo anaranjado. Núcleos: ***** azulado. |
|
NITRATO DE PLATA
|

El protocolo de impregnación de nitrato de plata se utiliza para poner de manifiesto tractos de fibras y cuerpos celulares en el sistema nervioso. La técnica se realiza sobre muestras de cerebro o médula espinal de unos milímetros de espesor.
|
Neuronas: marrón pálido con nucléolo patente.
Fibras (axones): *****, marrón. |
|
TINCIÓN DE WOECKLE
|
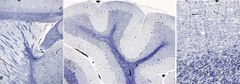
Esta tinción se usa para teñir la mielina del sistema nervioso central, aunque no sirve para la del sistema nervioso periférico. Es útil en estudios de alteraciones de los tractos nerviosos o del tejido nervioso en general. También se emplea en casos de muerte celular puesto que las neuronas degeneradas aparecen completamente negras, mientas que en las normales sólo se tiñe el núcleo.
|
Glía y nucléolo: ******.
Vainas de mielina: azul oscuro. Neuronas en degeneración: soma *****. Fondo: claro. |