- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Leyendo...
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
Boton play
![]()
Boton play
![]()
68 Cartas en este set
- Frente
- Atrás
|
Diga 7 maquinas para el cambio de fase de una sustancia.
|
•Condensador
•Evaporador •Rehervidor •Int. Calor •Humificador •Aspersor •Secador |
|
¿Qué es un estado?
|
Es un conjunto univoco de propiedades de sustancias en un momento particular.
|
|
¿Qué es una propiedad de estado?
|
En termodinámica, es una magnitud física macroscópica que caracteriza el estado de un sistema en equilibrio y no la forma en la que el sistema llego a dicho estado (Independiente del camino recorrido)
|
|
¿Qué es el equilibrio?
|
Es el estado de una sustancia en el que no existe tendencia al cambio espontáneo, o estado en el que todas las velocidades para alcanzar dicho estado se balancean.
|
|
¿Qué propiedades de estado hay y cuál de estás se manejan en Estequiometría?
|
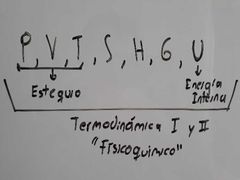
|
|
¿Qué se necesita para determinar el estado de una sustancia?
|
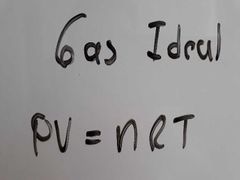
1, El sistema debe estár en equilibrio.
2, Conocer las relaciones existentes (leyes) entre las propiedades de estado de dicho sistema. Ejemplo: |
|
¿Qué es la conición de Gas Ideal?
|
Es aquella condición que cumple un gas cuando la distancia media entre las moléculas es lo suficientemente grande como para ignorar los efectos de las fuerzas intermoléculares de las mismas y se considera su volumen puntual.
|
|
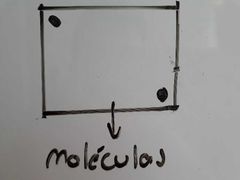
¿Qué ocurre si un Gas se desvia de la condición ideal?
|
Pueden pasar dos situaciones:
1, Se condensa. 2, Se empieza a comportar como gas real y se debe aplicar la ecuación de estado de Van der Waars. |
|
¿Qué restricciones debe cumplir un gas para que se pueda ver como un gas ideal?
|
1, No debe haber fuerzas intermoléculares.
2, Debe haber un volumen puntual. 3, La presión por debajo de los 5 [bar]. |
|
¿Qué dice la Ley de Boyle?
|
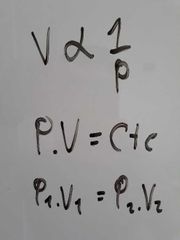
El volumen de una cantidad dada de gas a temperatura constante es inversamente proporcional a su presión.
|
|
¿Qué dice la Ley de Charles-Gay Lussac?
|

A presión constante el volumen de una cantidad dada de gas es directamente proporcional a su temperatura ABSOLUTA.
|
|
¿Qué dice la Ley de Avogadro?
|
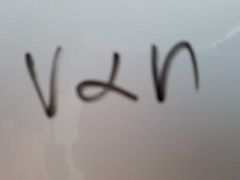
A volumenes iguales de gases a la misma temperatura y presión contienen el mismo número de moléculas.
|
|
¿De donde sale la ecuación de gases ideales y a qué es igual?
|
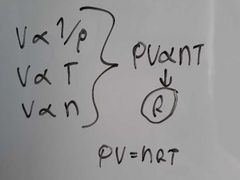
|
|
¿Qué dice la Ley de Dalton?
|
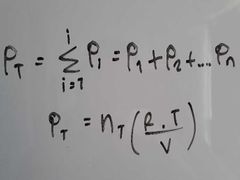
La presión total de un sistema es igual a la suma de las presiones parciales (Pi) de cada uno de los gases presentes.
|
|
¿Qué es y a qué es igual la presión parcial de un gas?
|
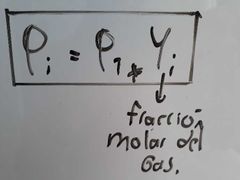
Es la presión que ejerce cada uno de los gases presentes en una mezcla sobre el sistema, como si estuviera solo en el volumen total de éste.
|
|
¿A qué es igual el calor de una sustancia?
|
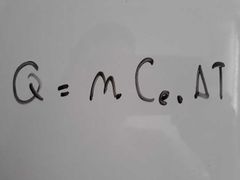
|
|
¿Qué tipos de calor tiene un liquido y un vapor?
|

|
|
¿Qué ocurre cuando una sustancia está por encima o por debajo de su temperatura crítica?
|
●Por encima:
No se puede licuar o condesar y además se comporta como un (GAS) ●Por debajo: Se puede licuar o condensar por aumento de la presión y puede alcanzar un equilibrio L-V. (VAPOR) |
|
¿Qué es el estado crítico de una sustancia?
|
Es aquel conjunto de condiciones físicas en la que la densidad del líquido y el vapor se hacen identicas.
|
|
¿Qué es la temperatura crítica?
|
Es la temperatura más alta a la cual una sustancia pura puede coexistir en dos fases. (Líquido-Vapor)
|
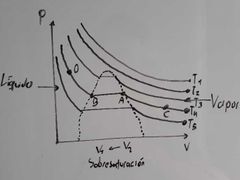
¿Cuál es la temperatura crítica en el diagrama de Thomas Andrews?
|
Es T3, ya que es la mínima temperatura a la cual la sustancia puede licuarse.
|
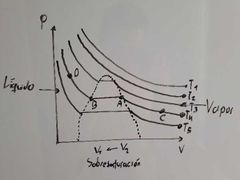
¿Qué representa el punto A en el diagrama de Thomas Andrews?
|
Es el vapor saturado:
Máxima cantidad de sustancia en fase vapor E condensación. |
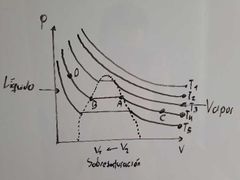
¿Que fenomeno se presenta entre el transcurso de A a B en el diagrama de Thomas Andrews?
|
Condensación.
|
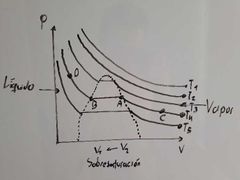
¿Qué fenomeno se presenta en el recorrido de B a A en el diagrama de Thomas Andrews?
|
Evaporación.
|
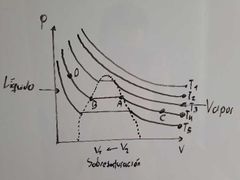
¿Que ocurre dentro de la región que está encerrada por los puntos A y B en el diagrama de Thomas Andrews?
|
Ocurre una coexistencia entre L-V (equilibrio).
|
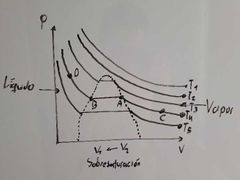
¿Qué representa el punto B en el diagrama de Thomas Andrews?
|
Representa Líquido Saturado:
Estado del liquido en el cual cualquier descomposición se traduce en evaporización. |
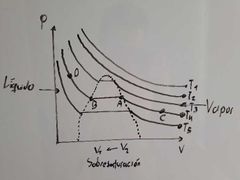
¿Qué representa el punto C en el diagrama de Thomas Andrews?
|
Representa Vapor Sobrecalentado:
Aquella condición de vapor en la cual su temperatura es lo suficientemente alta para que no E condensación por aumento de la presión. |
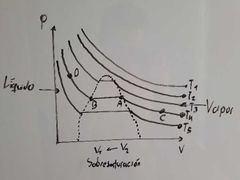
¿Qué representa el punto D en el diagrama de Thomas Andrews?
|
Representa Líquido Sobreenfriado:
Aquella condición del líquido en el cual la temperatura es lo suficientemente baja para que no E evaporación por descompresión. |
|
¿Que ocurre si el Kps de una sustancia que se disuelve en un solvente ea mayor, menor o igual?
|
MAYOR: No se satura.
IGUAL: está en equilibrio (saturado) MENOR: la sustancia precipita hasta alcanzar el equilibrio. |
|
¿Cómo es la ecuación de Antoine para hallar la presión de vapor de un líquido en °C y °K?
|
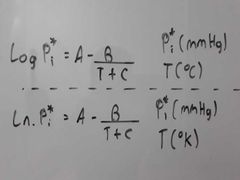
|
|
¿Cómo se si una sustancia está en equilibrio L-V?
|
Debe estár presente en los dos estados.
|
|
¿Cómo cambia la presión total de un sistema en la que un liquido llega y se mantiene en equilibrio L-V?
|
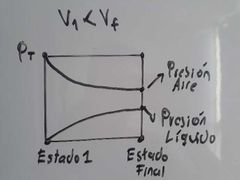
La presión total del sistema permanece constante, pero ahora es producida no solo por los gases que estaba inicialmente sino también por el liquido que alcanzó su equilibrio L-V, eso implica que el volumen del sistema cambie.
|
|
¿A cuánto equivale la presión de liquido en una mezcla de gases cuando éste está en equilibrio L-V?
|
Es igual a la presión de vapor que ejercería si estuviera solo dentro del sistema.
|
|
¿En qué se diferencia la presión de vapor de un líquido y la presión parcial de un vapor?
|
En que la presión de vapor hace referencia cuando el liquido se encuentra solo dentro del sistema, y la PRESIÓN PARCIAL cuando éste está dentro de una mezcla de gases.
|
|
Cuando un liquido está en una región en la que se presenta un equilibrio L-V ocurre una saturación parcial si está dentro de una mezcla ¿Qué tipos de saturación conforman la saturación parcial?
|
1, Saturación Relativa (SR).
2, Saturación Molal (SM). 3, Saturación Absoluta (Sa). 4, Saturación Porcentual (Sp). |
|
¿A qué es igual la Saturación Relativa?
|
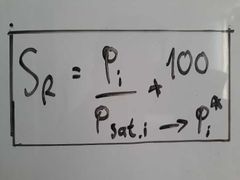
Pi es igual a Psat cuando el gas está saturado en vapor de la sustancia.
|
|
¿A qué es igual la Saturación Molar?
|

|
|
¿A qué es igual la Saturación Absoluta?
|
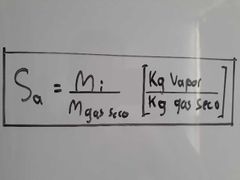
|
|
¿A qué es igual la Saturación Porcentual?
|

|
|
¿Cuál es el parámetro que mide la condensación-evaporación de una sustancia pura en equilibrio L-V?
|
Es la Presión de Vapor.
|
|
¿Qué ocurre si la presión parcial de un líquido es menor, igual o mayor a la presión de vapor?
|
MENOR: No condensa.
MAYOR: Condensa. IGUAL: Saturación. |
|
¿Por qué se evaporan las moléculas de un líquido en un equilibrio L-V?
|
Debido a la energía que tienen para salir del líquido.
|
|
¿Qué es la Presión parcial de un gas?
|
Es la presión que ejerce un gas en una mezcla de gases
|
|
¿Qué es la Presión de vapor de una sustancia pura?
|
Es la presión máxima que ejerce un vapor de una sustancia pura en equilibrio a temperatura constante.
|
|
¿Qué es la Saturación de un gas?
|
Es la máxima cantidad de vapor de un liquido que un gas puede contener.
|
|
¿Qué es la temperatura de rocío y qué factor influye en su determinación?
|
Es la temperatura a la cual el vapor de una sustancia empieza a condensar a presión constante,
depende de la cantidad de vapor de agua en el sistema (es decir, de la Humedad absoluta) y de la presión. |
|
¿Cuál es la diferencia entre la presión de vapor de un líquido y la presión parcial de un
vapor? |
La presión de vapor de un líquido se da en sustancias puras y la presión parcial de un vapor es la presión de dicho vapor en una mezcla de gases.
|
|
¿Cómo se podría determinar la fracción molar de un componente gaseoso a partir de las presiones parciales de cada componente en una mezcla?
|
Se deben sumar todas las presiones parciales para obtener la presión total del sistema y luego
se dividen las presiones parciales en la total para obtener las fracciones molares. |
|
¿Cuál es la relación entre la temperatura crítica de una sustancia y su equilibrio L-V?
|
El equilibrio L-V solo se da cuando la temperatura es menor a la temperatura crítica.
|
|
¿Qué le sucede a la temperatura de rocío cuando se calienta un aire húmedo a presión constante?
|
No le sucede nada, la temperatura de rocío solo se ve afectada por la cantidad de vapor de
agua en el sistema. |
|
¿Qué le sucede a la temperatura de bulbo húmedo cuando se realiza un proceso de
saturación adiabática? |
No le sucede nada a la temperatura de rocío, en cambio, la temperatura de bulbo seco sí
disminuye. |
|
¿Cuál es la máxima presión que puede alcanzar una sustancia en estado de equilibrio y qué
parámetro influye sobre ella? |
Es la presión de vapor del líquido (Pi*) y depende de la temperatura a la que se encuentre, si
la temperatura aumenta la presión de vapor también y viceversa. |
|
¿Cuál es la diferencia entre vapor saturado y gas saturado en vapor. Qué presiones definen cada uno de esos estados?
|
• El gas saturado en vapor es una condición que se presenta cuando una sustancia alcanza su equilbrio L-V dentro de una mezcla de gases y el vapor saturado es una situación que existe cuando se genera vapor de una sustancia a su temperatura de ebullición.
|
|
¿Qué le sucede a la temperatura de rocío si se incrementa la presión total del sistema?
|
• La temperatura de rocio va a aumentar ya que las moléculas de la sustancia van a estar mas unidas y se va a facilitar su condensación.
|
|
¿Qué le sucede a la humedad relativa si se comprime el aire a temperatura constante?
|
A temperatura constante la presión de vapor es contante, pero al aumentar la presión total la
presión parcial del agua aumenta, por lo que la humedad relativa aumenta también. |
|
¿Qué le ocurre a la humedad absoluta si se realiza un enfriamiento evaporativo?
|
La humedad absoluta aumenta en un enfriamiento evaporativo.
|
|
¿Qué significa en términos de humedad relativa si se incrementa la variación entre Tbs y Tbh?
|
Como Tbh y Tbs son iguales para HR=100%, al aumentar la variación entre estas temperaturas la HR se aleja más de su máximo, es decir, HR decrece.
|
|
Si el aire está saturado con vapor de agua, describa ¿cómo varía la humedad relativa y absoluta del aire si: a) se calienta a Pcte, b) se enfría a Pcte, c) se expande a Tcte y d) se comprime a Tcte?
|
a) La HR disminuye y la Ha se mantiene constante.
b) La HR se mantiene constante y Ha disminuye porque hay menos vapor de agua en el sistema. c)La HR disminuye porque hay menor presión parcial de agua e igual presión de vapor de agua, pero Ha se mantiene constante. d)La HR permanece constante y Ha disminuye porque hay menos vapor en el sistema. |
|
Si un gas está saturado con vapor de agua, describa brevemente qué le sucede al vapor de agua si la mezcla Se calienta a presión constante.
|
El vapor de agua no sufre ningún cambio.
|
|
Si un gas está saturado con vapor de agua, describa brevemente qué le sucede al vapor de agua si la mezcla Se enfría a presión constante.
|
El vapor de agua condensa.
|
|
Si un gas está saturado con vapor de agua, describa brevemente qué le sucede al vapor de agua si la mezcla Se expande a temperatura constante.
|
El vapor de agua no sufre ningún cambio.
|
|
Si un gas está saturado con vapor de agua, describa brevemente qué le sucede al vapor de agua si la mezcla Se comprime a temperatura constante.
|
El vapor de agua condensa.
|
|
Indique si los siguientes enunciados son verdaderos o falsos (V o F) con relación a un aire húmedo después de un proceso de saturación adiabática:
a) Hm se mantiene constante y Ha aumenta b) Hm se mantiene constante y Ha disminuye c) Hm y Ha se mantienen constantes d) Pagua y HR se mantienen constantes e) Pagua y HR disminuyen f) Pagua y HR aumentan g) Trocío aumenta h) Trocío disminuye i) Trocío se mantiene constante j) Tbs aumenta k) Tbs disminuye l) Tbs se mantiene constante m) Tbh aumenta n) Tbh disminuye o) Tbh se mantiene constante |
a) (F, Hm también aumenta)
b) (F, Hm y Ha aumentan) c) (F, ambas aumentan) d) (F, Pagua aumenta y HR también) e) (F, ambas aumentan) f) (V) g) (V) h) (F, como aumenta Ha, la Tr también aumenta) i) (F, como aumenta Ha, la Tr también aumenta) j) (F, en una saturación adiabática Tbs disminuye) k) (V) l) (F, en una saturación adiabática Tbs disminuye) m) (F, la Tbh no sufre ningún cambio) n) (F, la Tbh no sufre ningún cambio) o) (V) |
|
¿A qué es igual la constante de gases ideales para diferentes unidades?
|
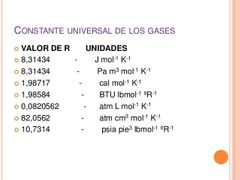
|
|
¿A cuántos Pascales equivale una Atmosfera?
|
101325 pas
|
|
¿A cuántos Kelvin equivale un Rankine?
|
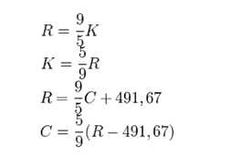
|
|
¿A cuántos grados Celsius equivale un Fahrenheit?
|

|
|
¿Qué son los grados de sobrecalentamiento?
|
GSC = T - Tr
Son la diferencia entre la temperatura a la que se encuentra el vapor y su temperatura de rocio. |