- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Leyendo...
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
Boton play
![]()
Boton play
![]()
46 Cartas en este set
- Frente
- Atrás
- 3er lado (pista)
|
Sistema
|
es el fenómeno en estudio
|
|
|
Entorno
|
lo que rodea al sistema (lo más próximo) el sistema actúa con el entorno
|
|
|
universo
|
donde se sitúa el sistema
|
|
|
límite
|
aquel que separa al sistema del entorno (paredes de un cuarto)
|
|
|
tipos de sistemas
|
abierto, cerrado y aislado
|
|
|
sistema abierto
|
existe trasferencia de materia y energia
|
|
|
sistema cerrado
|
existe transferencia de energía pero no de materia
|
|
|
sistema aislado
|
no existe transferencia de materia ni de energía
|
|
|
¿que es la energía?
|
es calor (q) y trabajo (w)
|
|
|
calor
|
si es positivo se absorbe calor y si es negativo se libera calor
|
|
|
trabajo
|
si es positivo se necesita trabajo y si es negativo se produce trabajo
|
|
|
el trabajo se compone de:
|
fuerza por desplazamiento, es decir, presión por la diferencia de volumen
|
|
|
sistema isobárico
|
sistema a presión constante
|
|
|
entalpía (H)
|
calor a presión constante
|
|
|
cálculo de entalpía por:
|
propiedad de estado, energías de enlace y ley de Hess
|
|
|
propiedad de estado
|
primero se balancea la ecuación, luego se escribe, la entalpía de los productos menos la entalpía de los reactivos
|
|
|
exotérmica
|
se libera calor, la entalpía es menor que cero
|
|
|
endotérmica
|
se absorbe calor, la entalpía es mayor que cero
|
|
|
adiabático
|
no hay transferencia de calor, la entalpía es igual a cero
|
|
|
perfil energético
|
gráfico que representa si el sistema es exotérmico o endotérmico
|
|
|
si la diferencia de H es: Hp-Hr
|
el sistema es exotérmico
|
|
|
si la diferencia de H es: Hr- Hp
|
el sistema es endotérmico
|
|
|
entalpía de formación
|
es la entalpía en la que se forma un mol de sustancia
|
|
|
energía de enlace
|
primero se balancea, luego se hace la estructura de Lewis, y después se remplaza por los valores en la tabla
|
|
|
en la energía de enlaces
|
se rompen enlaces en el lado de los reactivos y se forman enlaces en el lado de los productos
|
|
|
en la energía de enlace
|
el número de los reactivos es positivo y el de los productos es negativo
|
|
|
entropía
|
habla sobre el grado de desorden en un proceso químico
|
|
|
segunda ley de la termodinámica
|
el universo tiende al desorden
|
|
|
se tiende al desorden si:
|
se forman gases y cuando baja la temperatura
|
|
|
factibilidad
|
es la espontaneidad de la reacción, es mas probable que ocurra
|
|
|
para pasar de yul partido kilos a kilos yul
|
se debe dividir los yul partido kilos por mil
|
|
|
la entropía del universo es
|
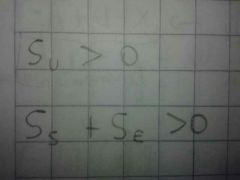
|
|
|
entropía del sistema
|

|
|
|
entropía del entorno es igual a
|
menos la entalpía del sistema partido por la temperatura en grados Kelvin
|
|
|
la entropía del universo es igual a
|
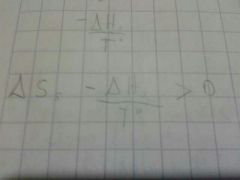
|
|
|
el orden
|
es una posición determinada, lo que gasta energía
a mayor grado de desorden, mayor es la factibilidad de la reacción |
|
|
tercera ley de la termodinámica: la energía libre de Gibbs es
|
menos la temperatura por la entropía del universo
|
|
|
la energía de Gibbs es
|
la entalpía del sistema menos la temperatura por la entropía del sistema, el resultado debe ser negativo para que ocurra
|
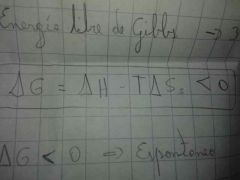
|
|
si G es menor que cero
|
es espontánea
|
|
|
si G es mayor que cero
|
no ocurre
|
|
|
entalpía negativa y entropía positiva
|
proceso exotérmico que tiende al desorden, altamente factible
|
|
|
entalpía negativa y entropía negativa
|
proceso exotérmico que tiende al orden, factible solo si la entalpía es mayor que la entropía de energía organizativa
|
|
|
entalpía positiva y entropía negativa
|
proceso endotérmico que tiende al orden, no es factible
|
|
|
entalpía positiva y entropía negativa
|
proceso endotérmico que tiende al desorden, factible sólo sí la entalpía es menor que la entropía de energía organizativa
|
|
|
la entalpía de energía total (H) es igual a
|
la energía libre (G) más la entropía de energía organizativa ( T S)
|
|
|
la enero libre es igual a
|
la energía libre de los productos menos la energía libre de los reactivos
|