- Barajar
ActivarDesactivar
- Alphabetizar
ActivarDesactivar
- Frente Primero
ActivarDesactivar
- Ambos lados
ActivarDesactivar
- Leer
ActivarDesactivar
Leyendo...
Cómo estudiar sus tarjetas
Teclas de Derecha/Izquierda: Navegar entre tarjetas.tecla derechatecla izquierda
Teclas Arriba/Abajo: Colvea la carta entre frente y dorso.tecla abajotecla arriba
Tecla H: Muestra pista (3er lado).tecla h
Tecla N: Lea el texto en voz.tecla n
![]()
Boton play
![]()
Boton play
![]()
22 Cartas en este set
- Frente
- Atrás
|
qué son enzimas?
|
Proteínas (no todas), capaces de catalizar muy eficientemente reacciones químicas.
|
|
Características de enzimas
|
Alta especificidad por sustratos
llevan a cabo la catálisis en medio acuoso requieren condiciones específicas de pH y temperatura Estructura 3D es crucial para su actividad catalítica muchas requieren de cofactores y coenzimas mal funcionamiento asociado a muchas enfermedades. |
|
Enzimas y temperatura
|
tiene una temperatura óptima que suele ser la corporal, luego de ahí se desnaturaliza.
|
|
Enzimas y pH
|
Es específico para cada una, por ejemplo la pepsina funciona en medios ácidos, se encuentra en el estómago.
|
|
Clasificación de las enzimas
|
nombre relacionado al sustrato + terminación asa
oxidoreductasa transferencia de electrones transferasa transferencia de grupos hidrolasa reacciones de hidrolisis liasa rotura de enlaces isomerasa transferencia de grupos para producir isómeros ligasa formación de enlaces. |
|
Cómo funcionan las enzimas?
|
Enzimas poseen un sitio específico donde las moléculas que reaccionan ingresan, con lo cual quedan cerca en orientación precisa (sitio activo)
No alteran equilibrio de las reacciones solo su probabilidad. |
|
Sitio activo
|
lugar donde ingresan sustratos para convertirse en productos
la formación de complejo enzima sustrato es crucial disminuyen la energía de activación, lo que aumenta la tasa (velocidad) de reacción. |
|
DeltaG: energía de activación
|
cantidad de energía para alcanzar estado de transición (en este caso complejo enzima sustrato)
Diferencia entre el estado basal y el estado de transición, entre más grande, más lenta es reacción. |
|
El estado de transición es:
|
el punto en el cuál es igualmente probable el avance (P) o retroceso (S).
|
|
Intermediarios de reacción
|
cada reacción tiene varios pasos en los que se da la formación y decaimiento de sp químicas transitorias.
|
|
Importancia biológica de los intermediarios de reacción
|
estos hacen que haya un paso limitante, impiden que las macromoléculas se rompan de forma espontánea y las células no sean viables.
|
|
En que radica el poder catalítico y su especificidad
|
Especificidad: discriminan entre sustratos muy similares
su capacidad de disminuir la energía de activación, de 5 a 17 órdenes de magnitud. |
|
Cómo se puede explicar el poder catalítico
|
reacomodo de enlaces covalentes entre grupos funcionales de E con S durante la reacción
Interacciones no covalentes (débiles) entre S y E. |
|
Energía de unión
|
Energía resultante de la interacción ES, principal fuente de energía libre usado por las enzimas para disminuir la energía de activación.
|
|
Explique el modelo de ajuste inducido
|
Los sitios activos de la enzima no son complementarios a los sustratos,si no a los estados de transición que se forman durante la reacción.
|
|
Cinética enzimática
|
Permite determinar la tasa (velocidad) de reacción y como esta se ve modificada en respuesta a cambios en parámetros experimentales.
|
|
Velocidad de reacción
|
se define como el cambio en la concentración de sustrato (o producto) por unidad de tiempo.
|
|
Concentración de enzima y velocidad
|
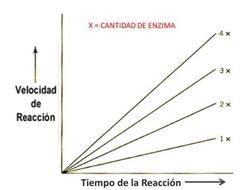
aumenta conforme aumente la enzima
sustrato casi siempre está en exceso. |
|
Concentración de sustrato y velocidad
|

aumenta hasta cierto punto, luego se hace constante, ya que la enzima se satura
la Vmax generalmente no se alcanza ya que se pasa perdiendo sustrato que se convierte en producto. |
|
Constante de Michaelis Menten Km
|
Concentración de sustrato a la cual alcanzamos la mitad de la velocidad máxima
Es específico para cada reacción y diferente en cada enzima. |
|
Entre menor km tenga una enzima para un sustrato:
|
necesito menos sustrato, o sea, la enzima es más afín.
|
|
Ecuación de Lineweaver-Burk
|
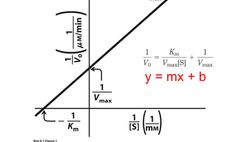
permite la obtención simple de km y Vmax
|